Accueil > 02 - SCIENCES - SCIENCE > Atome : La rétroaction de la matière/lumière et du vide (de la (...) > Qu’est-ce que la chaleur (en Physique et en Chimie) ?
Qu’est-ce que la chaleur (en Physique et en Chimie) ?
mardi 6 novembre 2018, par
La transformation entre énergie mécanique et chaleur
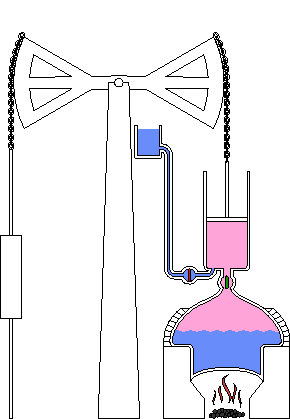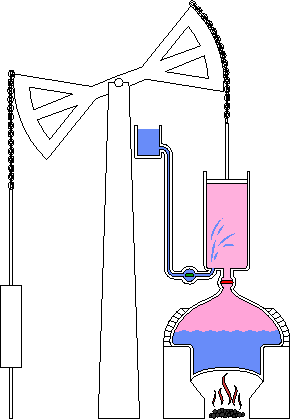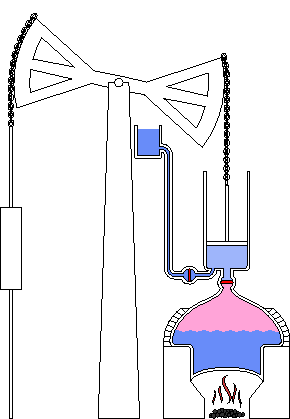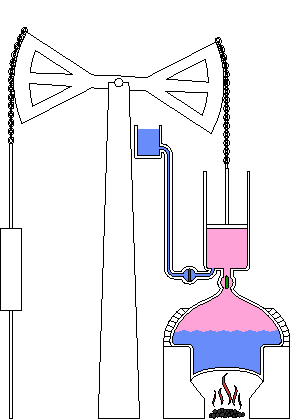
Chocs entre molécules

L’agitation moléculaire amène les fluides à exercer des pressions sur des surfaces et à occuper tout le volume
La chaleur mesure l’agitation moléculaire, à la fois déplacement des molécules, des atomes au sein de la molécule, des atomes eux-mêmes, et même des atomes au sein du vide quantique, lui-même sans cesse agité...
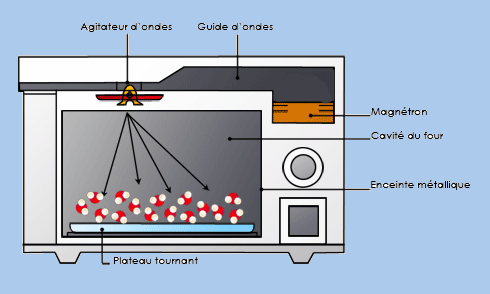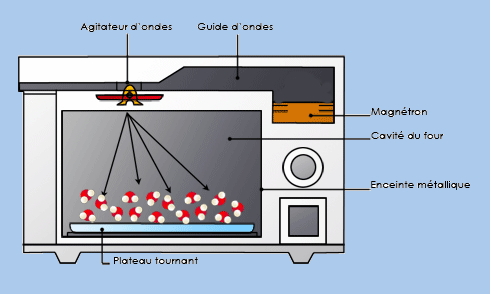
L’exemple du four micron-ondes qui chauffe en agitant les molécules

Les physiciens énergétistes ont longtemps cru que la chaleur était un fluide, appelé "le calorique", et c’était une conception erronée.
Ce n’est pas un gaz. Cependant, elle se fonde sur des corps matériels éphémères, les couples particule/antiparticule du vide quantique qui entretiennent une agitation permanente qui se communique aux particules, aux atomes et aux molécules.

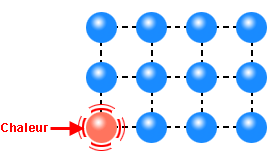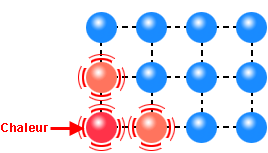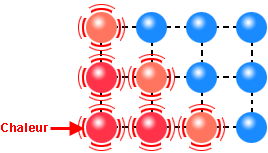

Le mouvement brownien est une manifestation visible à notre échelle, au microscope, de l’agitation moléculaire, elle-même activée par celle du vide quantique

Agitation d’une molécule

Couple électron-antiélectron se transformant en énergie du vide quantique

Imaginer le vide quantique, comme si on le voyait...

Qu’est-ce que la chaleur (en Physique et en Chimie) ?
Avertissement : dans le langage courant, chaleur et augmentation de température son identiques, mais cela n’est pas le cas en Physique et en Chimie. La chaleur n’est que l’un des moyens d’augmenter la température et sa quantité n’est pas identique à celle de l’augmentation de température. Le travail mécanique est un moyen d’augmenter la température sans augmenter la chaleur. La différence entre température et quantité de chaleur peut être illustrée par un exemple simple : un objet matériel plongé dans l’eau de mer peut être, au bout d’un certain temps, à la même température que l’eau mais n’a certainement pas la même quantité de chaleur que la mer !!! On se souvient que toute l’Antiquité a été dominée par l’idée que « le feu » était un des « quatre éléments », eau, air, feu et terre… et donc la chaleur était considérée comme un objet matériel. Au lieu de matière, nous considérons aujourd’hui que la chaleur est une des formes de l’énergie, et qu’elle est la plus basse qualitativement parlant, c’est-à-dire la moins ordonnée, de toutes les formes d’énergie, celle qui correspond à la plus profonde dégradation de l’énergie pour reprendre le terme du physicien Brunhes.
Concernant cet avertissement, lire ici
La chaleur a été l’une des énigmes que la science a tenté de décrypter avec des points de vue dichotomiques : est-elle soit matière soit énergie, soit mécanique soit énergétique, soit bosons soit fermions, soit objets matériels soit transformations ondulatoire du vide, soit matière soit mouvement (ou objets matériels ou mouvement d’objets, mouvements de la matière ou dans la matière, ou transformations ou déplacements de la matière, etc.), soit agitation aléatoire soit mouvement déterministe, soit onde de chaleur soit corpuscules porteurs d’énergie de chaleur, soit ordre soit désordre, soit agitation soit structure, etc… D’où des polémiques sans fin sur des alternatives opposées (qui ne devaient pas l’être de manière diamétrale mais dialectique), mais au travers desquelles les connaissances ont cependant progressé considérablement.
En fait, comme l’exprimait Engels dans « Dialectique de la nature » et dans « L’Anti-Dühring », matière et mouvement sont, dialectiquement, contradictoires et inséparables. Dans toute matière, il y a du mouvement et dans tout mouvement il y a de la matière. Cependant, matière et mouvement obéissent apparemment à des lois opposées (par exemple, loi de Fermi et loi de Bose-Einstein, suivant qu’il s’agit de bosons ou de fermions).
Engels écrivait ainsi dans « L’Anti-Dühring » : « Le mouvement est le mode d’existence de la matière. Jamais ni nulle part, il n’y a eu de matière sans mouvement, ni il ne peut y en avoir. Mouvement dans l’espace de l’univers, mouvement mécanique de masses plus petites sur chaque corps céleste, vibration moléculaire sous forme de chaleur ou de courant électrique ou magnétique, décompositions et combinaisons chimiques, vie organique : chaque atome singulier de matière dans l’univers participe à chaque instant donné à l’une ou à l’autre de ces formes de mouvement, ou à plusieurs à la fois. Tout repos, tout équilibre est seulement relatif, n’a de sens que par rapport à telle ou telle forme de mouvement déterminé… Le changement de forme du mouvement a été découvert seulement depuis 1842, et c’est cela, et non la loi de la constance quantitative, qui est la nouveauté. »
Engels écrivait également dans « Dialectique de la nature » : « Le mouvement, au sens le plus général, conçu comme mode d’existence de la matière, comme attribut inhérent à elle, embrasse tous les changements et tous les processus qui se produisent dans l’univers, du simple changement de lieu jusqu’à la pensée. »
Eftichios Bitzakis écrit dans « Physique contemporaine et Matérialisme dialectique :
« Il y a une contradiction, qui date au moins de Newton, entre la matière et le mouvement. Newton identifiait la catégorie de la matière et le concept de la masse : « Quantité de matière : c’est cette quantité que l’entends désormais par le nom corps ou masse » (« Principia » de Newton). Pourtant du temps de Newton déjà, la masse était la mesure d’une des propriétés de la matière, l’inertie. Mais l’identification de la masse et de la matière a dominé la physique classique, et continue de dominer même la physique contemporaine. Selon cette conception, ce qui n’a pas de masse n’est pas matériel. Et étant donné qu’on considérait l’ « énergie » comme impondérable, on a divisé l’univers en deux entités distinctes et irréductibles : la masse-matière, et l’énergie (immatérielle). L’énergie se présentait donc comme quelque chose d’extérieur à la matière, qui lui donnait mouvement et vie…
Engels fut le premier à analyser du point de vue dialectique cette contradiction… Il était opposé au terme « énergie » pour plusieurs raisons, et pour la raison fondamentale que ce terme « laisse encore place à l’illusion que l’énergie est quelque chose d’extérieur à la matière, quelque chose qui lui est apporté du dehors » (Engels, « Dialectique de la nature »)
La conception mécaniste se contentait d’une matière sans mouvement interne. Cette conception a conduit à l’inverse : à concevoir le mouvement sans matière. Une des expressions de cette conception était et demeure les différentes formes de l’énergétisme, qui veut supprimer la matière et construire un univers d’une substance unique et immatérielle : l’énergie….
La mode était à l’énergétisme d’Ostwald, qui croyait qu’il avait dépassé la contradiction entre la matière et l’esprit, par la réduction des deux termes de la contradiction à un seul et même terme unitaire : l’énergie…
Citons à ce propos le témoignage de Paul Langevin :
« Je me rappelle avoir lu, vers 1894, un article d’Ostwald, qui était un véritable hymne où débordait la foi énergétique. L’auteur propagea même une sorte de religion, un monisme particulier, fondé sur les principes de la thermodynamique, et crut pouvoir placer à la base de la morale un axiome fondamental : « Ne dégradons pas l’énergie » ! » (Paul Langevin, « La valeur éducative de l’histoire des sciences »)
Sur la nature physique de la chaleur et sur la fin de l’hypothèse du calorique et de la chaleur-substance, lisons « L’évolution des idées en Physique » de Einstein et Infeld :
« La chaleur est-elle une substance ?
« Les concepts les plus fondamentaux dans la description des phénomènes de la chaleur sont ceux de « température » et de « chaleur ». Il fallut un temps incroyablement long dans l’histoire de la science pour établir une distinction entre ces deux concepts, mais une fois cette distinction faite, des progrès rapides en furent le résultat. Bien que ces concepts soient maintenant familiers à chacun, nous voulons les examiner de plus près, en faisant ressortir les différences qui existent entre eux.
Notre sens du toucher nous dit d’une manière déterminée que tel corps est chaud et tel autre froid. Mais ceci est un critère purement qualitatif, insuffisant pour une description quantitative, et parfois même ambigu.
On peut le montrer par une expérience bien connue. Supposons trois vases contenant respectivement de l’eau froide, tiède et chaude. Si nous plongeons une main dans l’eau froide et l’autre dans l’eau chaude, nous recevons de la première le message qu’elle est froide et de la seconde qu’elle est chaude. Si ensuite nous plongeons les deux mains dans la même eau tiède, les messages que nous recevons de chaque main se contredisent.
Pour la même raison, un Esquimau et un natif de quelque pays équatorial se rencontrant à New York un jour de printemps émettront des opinions différentes sur le climat ; l’un dira qu’il est chaud, l’autre qu’il est froid.
Nous réglons toutes ces questions par l’emploi d’un thermomètre, un instrument qui, sous sa forme primitive, fut construit par Galilée. Ici également surgit également ce nom familier !
L’emploi du thermomètre est basé sur quelques suppositions physiques évidentes. Nous allons les rappeler en citant quelques lignes des conférences faites par Black il y a environ cent cinquante ans ; il a beaucoup contribué à éclaircir les difficultés qui sont liées aux deux concepts de chaleur et de température.
« En nous servant de cet instrument nous avons appris que si nous prenons mille espèces différentes de matières ou plus, telles que des métaux, des pierres, des sels, du bois, des plumes, de la laine, de l’eau et divers autres fluides, qui possèdent des chaleurs différentes, et les plaçons dans la même pièce non chauffée et où le soleil ne pénètre pas, les plus chauds de ces corps communiqueront leur chaleur aux plus froids, pendant quelques heures peut-être ou une journée ; si au bout de ce temps nous appliquons le thermomètre successivement à chacun d’entre eux, il marquera exactement le même degré. »
Les mots « chaleurs » doivent, conformément à la nomenclature d’aujourd’hui, être remplacés par « températures »…
Supposer que deux corps possèdent des quantités de chaleur égales parce que leurs températures sont égales, ce serait, remarque Black, « prendre une vue trop rapide du sujet. C’est confondre la quantité de chaleur dans des corps différents avec sa force ou son intensité générale, bien qu’il soit manifeste que ce sont là deux choses différentes, qui devraient toujours être distinguées quand nous réfléchissons sur la distribution de la chaleur. »
On arrive à comprendre cette distinction en faisant une expérience très simple. Un litre d’eau chauffée avec un brûleur à gaz met quelques temps pour passer de la température de la pièce au point d’ébullition. Un temps plus long est nécessaire pour chauffer douze litres d’eau dans le même vase et avec le même brûleur à gaz. Nous interprétons ce fait en disant que maintenant « quelque chose » de plus est nécessaire et nous appelons ce quelque chose « chaleur ».
Un autre concept important, la « chaleur spécifique », est obtenu en poursuivant cette expérience : versons dans un vase un litre d’eau et dans un autre un litre de mercure et chauffons-les de la même manière. Le mercure s’échauffe beaucoup plus rapidement que l’eau, ce qui montre que beaucoup moins de chaleur est nécessaire pour élever sa température d’un degré.
En général, différentes quantités de « chaleur » sont nécessaires pour élever d’un degré les températures de différentes substances, telles que l’eau, le mercure, le fer, le cuivre, le bois, etc., supposé que toutes soient de masse égale. Nous disons que chaque substance a une « capacité calorifique » individuelle ou une « chaleur spécifique ».
Une fois que nous avons obtenu le concept de chaleur, nous pouvons étudier sa nature de plus près. Prenons deux corps, l’un chaud, l’autre froid, ou, pour parler plus précisément, l’un étant à une température plus élevée que l’autre. Mettons-les en contact et libérons-les de toutes les influences extérieures. Nous savons qu’ils finiront par être à la même température. Mais comment cela se produit-il ? Que se passe-t-il entre l’instant où ils sont mis en contact et celui où ils sont à la même température ?
L’image de la chaleur « s’écoulant » d’un corps à l’autre se présente d’elle-même, semblable à l’eau qui s’écoule d’un niveau supérieur à un niveau inférieur… L’écoulement a lieu jusqu’à ce que les deux niveaux, c’est-à-dire ici les deux températures, soient égales. Cette vue naïve peut être rendue utile par des considérations quantitatives.
Si des masses déterminées d’eau et d’alcool, dont chacune est à une température définie, sont mélangées ensemble, la connaissance de leurs chaleurs spécifiques permet de prédire la température finale du mélange. Inversement, la détermination de la température finale et un peu d’algèbre nous permet de trouver le rapport entre les deux chaleurs spécifiques.
Le concept de chaleur qui se présente ici a une ressemblance avec d’autres concepts physiques. La chaleur, d’après notre conception, est une substance, comme la masse en mécanique. Sa quantité peut varier ou ne pas varier, comme la monnaie qu’on met de côté dans un coffre-fort reste intacte aussi longtemps qu’il reste fermé, et il en sera de même de la quantité de masse et de chaleur dans un corps isolé…. La chaleur latente est temporairement cachée, comme l’argent mis dans un coffre-fort, mais qui peut être utilisé si l’on connaît le mécanisme de la serrure.
Mais la chaleur n’est certainement pas une substance dans le même sens que la masse. Celle-ci peut être mise en évidence au moyen de la balance, mais en est-il de même de la chaleur ?
Un morceau de fer chauffé au rouge pèse-t-il plus que quand il est à la température de la glace ?
L’expérience montre qu’il n’en est pas ainsi. Si la chaleur est une substance, elle est sans poids. La « chaleur-substance » était habituellement appelée « calorique », et c’est pour première fois que nous faisons connaissance d’un membre de toute une famille de substances sans poids. Plus tard, nous aurons l’occasion de suivre l’histoire de cette famille, sa grandeur et sa décadence. Pour le moment nous nous contentons de signaler la naissance de ce membre particulier.
Le but d’une théorie physique quelconque est d’expliquer un domaine aussi vaste que possible de phénomènes. Elle se justifie dans la mesure où elle rend les événements intelligibles. Nous avons vu que la théorie de la « chaleur-substance » explique beaucoup de phénomènes de la chaleur. Il deviendra cependant bientôt évident que ceci est une fausse piste, car la chaleur ne peut pas être regardée comme une substance, même sans poids. Cela devient clair si nous réfléchissons sur quelques expériences simples qui marquèrent le commencement de la civilisation.
Nous concevons la substance comme une chose qui ne peut ni être créée ni être détruite. Mais l’homme primitif a créé par le frottement de la chaleur suffisante pour allumer le bois. Les exemples d’échauffement par le frottement sont en fait trop nombreux et familiers pour qu’il soit nécessaire de les citer. Dans tous les cas une certaine quantité de chaleur est créée, un fait qui est difficile à expliquer par la théorie de la « chaleur-substance »…
Les preuves capables de décider de la vie ou de la mort d’une théorie se rencontrent souvent dans l’histoire de la physique et sont appelées « expériences cruciales »…
Cette expérience fut faite, il y a cent cinquante ans environ, par Rumford et porta un coup mortel à la théorie de la « chaleur-substance ».
Un extrait de son propre exposé nous fera connaître son observation :
« Il arrive souvent, dans les affaires ordinaires et les occupations de la vie, que des occasions favorables de contempler les opérations les plus curieuses de la Nature s’offrent à nous d’elles-mêmes ; des expériences physiques très intéressantes peuvent souvent être faites, presque sans peine et sans dépense, au moyen de machines inventées pour satisfaire simplement les besoins de l’industrie… Ayant été occupé dernièrement à surveiller le forage des canons dans les ateliers de l’arsenal militaire de Munich, je fus frappé du degré considérable de chaleur que peut atteindre, dans un court espace de temps, un canon de cuivre qu’on fore, et de la chaleur plus intense encore (plus intense que celle de l’eau bouillante, comme je l’ai constaté par l’expérience) que possèdent les copeaux de métal séparés de la tarière… D’où vient la chaleur réellement produite par l’opération mécanique mentionnée plus haut ? Est-elle fournie par les copeaux qui sont séparés par la tarière de la masse solide du métal ? S’il en était ainsi, la capacité, conformément aux doctrines modernes de la chaleur latente et du calorique, devrait alors non seulement changer, mais le changement qu’ils ont subi devrait être suffisamment grand pour rendre compte de toute la chaleur produite. Mais aucun changement de ce genre ne s’est produit, car en prenant des quantités de poids égal de ces copeaux et de bandes minces du même bloc de métal, détachées par une scie fine, et en les mettant ensemble à la même température (celle de l’eau bouillante) dans des quantités égales d’eau froide (c’est-à-dire à la température de 59 degrés fahrenheit et demi), la portion d’eau où furent jetés les copeaux n’était pas, selon toute apparence, plus chaude, ou moins, que l’autre portion où furent jetées les bandes de métal. »
Voilà finalement sa conclusion :
« Et en réfléchissant sur ce sujet nous ne devons pas oublier de prendre en considération cette circonstance hautement remarquable que la source de chaleur produite, dans ces expériences, par le frottement paraissait manifestement inépuisable. Il est à peine nécessaire d’ajouter que ce qu’un corps isolé quelconque, ou un système de corps, peut continuer à fournir sans limitation, ne peut pas être une substance matérielle ; et excepté le mouvement, il me paraît extrêmement difficile, pour ne pas dire tout à fait impossible, de se former l’idée distincte d’une chose quelconque capable d’être excitée et transmise de la manière que, dans ces expériences, la chaleur fut excitée et transmise. »
Nous voyons ainsi que la vieille théorie s’écroule…
Ce fut Mayer qui, il y a moins de cent ans, fit une conjecture qui conduisit au concept de la chaleur comme une forme de l’énergie, et qui fut confirmée expérimentalement par Joule.
C’est une coïncidence étrange que presque tout le travail fondamental se rapportant à la nature de la chaleur ait été accompli par des physiciens non professionnels, qui regardaient la physique simplement comme leur grand dada. Ce furent l’Ecossais versatile Black, le médecin allemand Mayer et le comte Rumford, le grand aventurier américain qui vivait ensuite en Europe et qui, parmi d’autres fonctions, remplit celle de ministre de la guerre en Bavière. Il y avait aussi le brasseur anglais Joule qui, dans ses rares moments de loisir, fit quelques-unes des expériences les plus importantes concernant la conservation de l’énergie.
Joule vérifia par l’expérience la conjecture que la chaleur est une forme de l’énergie et détermina le rapport des valeurs. Il vaut la peine d’examiner ce qu’étaient au juste ses résultats.
L’énergie cinétique et l’énergie potentielle d’un système constituent ensemble son énergie « mécanique »…
Nous avons fait la conjecture qu’une partie de l’énergie mécanique était convertie en chaleur. Si cela est vrai, il doit y avoir ici et dans tous les autres processus physiques similaires un certain rapport entre les deux.
Ceci est rigoureusement une question quantitative, mais le fait qu’une quantité donnée d’énergie mécanique peut être transformée en une quantité définie de chaleur est de la plus haute importance.
Nous voudrions savoir quel nombre exprime le rapport, c’est-à-dire combien de chaleur nous obtenons d’une quantité donnée d’énergie mécanique.
la détermination de ce nombre fut l’objet des recherches de Joule. Le mécanisme d’une de ses expériences ressemble beaucoup à celui d’une horloge mue par un poids. Le remontage d’une telle horloge consiste à élever deux poids, par quoi l’on communique de l’énergie potentielle au système. Si l’on n’intervient plus, l’horloge peut être considérée comme un système clos. Graduellement les poids descendent et l’horloge marche. Au bout d’un certain temps, les poids atteindront le point le plus bas et l’horloge s’arrêtera. Que s’est-il passé avec l’énergie ? L’énergie potentielle des poids s’est transformée en énergie cinétique du mécanisme et s’est graduellement dissipée sous forme de chaleur.
Une modification convenable de ce mécanisme permit à Joule de mesurer la chaleur, et par suite, le rapport des valeurs. Dans son appareil, deux poids, qui descendaient le long des règles divisées, faisaient tourner des palettes immergées dans l’eau. L’énergie potentielle des poids était transformée en énergie cinétique des parties mobiles et, de là, en chaleur, qui détermina une élévation de la température de l’eau. Joule mesura ce changement de température et, faisant usage de la chaleur spécifique de l’eau, qui était déjà connue, il calcula la quantité de chaleur absorbée.
Il résuma les résultats de ses nombreux essais de la manière suivante :
« 1°) La quantité de chaleur produite par le frottement des corps, solides ou liquides, est toujours proportionnelle à la quantité de force (par force, Joule entendait énergie) dépensée. 2°) La quantité de chaleur capable d’élever la température d’une livre d’eau (posée dans le vide et à une température de 50° à 60°) d’un degré Fahrenheit, nécessite pour sa production la dépense d’une force mécanique (énergie) que représente la chute de 722 livres d’une hauteur d’un pied. »
En d’autres termes, l’énergie potentielle de 722 livres élevées à une hauteur d’un pied au-dessus du sol est équivalente à une quantité de chaleur nécessaire pour élever la température d’une livre d’eau de 55° à 56° Fahrenheit. Les expériences ultérieures ont permis d’atteindre une précision plus grande, mais l’équivalent mécanique de la chaleur est essentiellement l’œuvre de Joule.
Une fois ce travail important accompli, le progrès ultérieur fut rapide. Il fut reconnu bientôt que ces espèces d’énergie, mécanique et thermique, ne présentent que deux formes entre beaucoup d’autres.
Tout ce qui peut être converti en l’une ou en l’autre est aussi une forme d’énergie.
La radiation émise par le soleil est de l’énergie, car une partie se transforme en chaleur sur la terre. Un courant électrique possède de l’énergie, car il échauffe un fil métallique ou met en mouvement les roues d’un moteur…
Est-il possible d’expliquer les phénomènes de la chaleur par des mouvements de particules agissant les unes sur les autres au moyen de forces simples ?
Un vase fermé contient une certaine masse d’un gaz, d’air par exemple, à une certaine température. En chauffant, nous élevons la température et augmentons l’énergie. Mais de quelle façon cette chaleur est-elle liée au mouvement ?
La possibilité d’une telle connexion est suggérée aussi bien par notre point de vue philosophique, accepté provisoirement, que par la façon dont la chaleur est produite par le mouvement. La chaleur doit être une énergie mécanique, si tout le problème est un problème mécanique.
L’objet de la « théorie cinétique » est de présenter le concept de la matière justement de cette manière. Un gaz, selon cette théorie, est un amas d’un nombre énorme de particules ou « molécules », qui se meuvent dans toutes les directions, se heurtent les unes contre les autres et changent de direction après chaque collision.
Il doit exister une vitesse moyenne de ces molécules, exactement comme dans une grande communauté humaine, il existe un âge moyen ou une richesse moyenne. Il y aura, par conséquent, une énergie cinétique moyenne par particule. Plus de chaleur dans le vase signifie une énergie cinétique moyenne plus grande.
La chaleur, conformément à cette image, n’est pas une forme spéciale d’énergie, différente de l’énergie mécanique ; elle est exactement l’énergie cinétique du mouvement moléculaire.
A une température définie correspond, par particule, une énergie cinétique moyenne définie. Ceci n’est pas une supposition arbitraire. Nous sommes obligés de regarder l’énergie cinétique d’une molécule comme la mesure de la température d’un gaz, si nous voulons former une consistante image mécanique de la matière.
Cette théorie est plus qu’un jeu de l’imagination. On peut montrer que la théorie cinétique des gaz n’est pas seulement en accord avec l’expérience, mais qu’elle conduit réellement à une intelligence plus profonde des faits…
Le mouvement de particules dans un liquide fut rendu manifeste, pour la première fois, par le « mouvement brownien », phénomène remarquable, qui serait resté mystérieux et incompréhensible sans la théorie cinétique de la matière. Il a été observé par le botaniste Brown et expliqué quatre-vingt ans plus tard, au début de ce siècle…. Ce que Brown observait, c’était l’agitation incessante de granules en suspension dans l’eau et visibles au microscope…
Comment faut-il expliquer ce mouvement ? Il paraît contradictoire à toute l’expérience antérieure. L’observation de la position d’une de ces particules en suspension pendant trente secondes par exemple révèle la forme fantastique de son chemin. La chose bouleversante, c’est le caractère de son mouvement apparemment éternel.
Un pendule oscillant immergé dans l’eau s’arrête bientôt, si on ne lui imprime pas un mouvement par une force extérieure. L’existence d’un mouvement qui ne s’arrête jamais paraît contraire à toute l’expérience. Cette difficulté fut éclaircie d’une manière éclatante par la théorie cinétique de la matière.
Quand on observe l’eau avec un de nos plus puissants microscopes, on ne voit pas de molécules en mouvement, telles que les dépeint la théorie cinétique de la matière. Il faut en conclure que si la théorie qui considère l’eau comme un amas de particules est juste, leur volume doit être au-delà des limites de visibilité des meilleurs microscopes.
Restons néanmoins fidèles à la théorie et admettons qu’elle représente une image conforme à la réalité. Les particules browniennes visibles au microscope sont bombardées par les plus petites qui constituent l’eau.
Le mouvement brownien existe, si les particules bombardées sont suffisamment petites. Il existe, parce que ce bombardement n’a pas lieu d’une manière uniforme de tous les côtés, et l’on ne peut pas, à cause de son caractère irrégulier et contingent, en établir une moyenne.
Le mouvement observé est ainsi le résultat d’un mouvement non observable.
Le comportement des grosses particules reflète jusqu’à un certain point celui des molécules et en constitue, pour ainsi dire, un grossissement si élevé qu’il devient visible au microscope.
Le caractère irrégulier et contingent du chemin que parcourent les particules browniennes reflète une irrégularité similaire des chemins que parcourent les particules plus petites qui constituent la matière. »
« La dégradation de l’énergie » de Bernard Brunhes :
« Formes inférieures de l’énergie – La chaleur
« Les formes diverses de l’énergie se classent en deux grandes catégories : formes supérieures et formes inférieures. Les diverses formes d’énergie mécanique proprement dite, l’énergie élastique, l’énergie électrique, rentrent dans la première catégorie ; l’énergie calorifique, l’énergie rayonnée, l’énergie mise en jeu dans les changements d’états physiques, rentrent dans la seconde catégorie. L’énergie chimique en général un mélange à doses complexes qui requiert une étude spéciale. Un caractère essentiel différencie les deux groupes : les formes supérieures ne comportent pas de degrés dans leur qualité. Elles sont, entre elles, de tout point, équivalentes. Les formes inférieures, au contraire, sont plus ou moins dégradées : elles présentent tous les intermédiaires entre une valeur égale à celle des formes supérieures et une valeur nulle. La chaleur représente de l’énergie de qualité d’autant plus relevée qu’elle est fournie par une source à plus haute température : de la chaleur rayonnée par une source à température infiniment élevée deviendrait équivalente en qualité à la même quantité d’énergie mécanique. Les formes les plus usuelles et les plus anciennement connues d’énergie supérieure sont celles dont l’étude est l’objet de la mécanique pure, celle qui sont utilisées par des machines dont le fonctionnement ne met en jeu aucun phénomène calorifique ou électrique – celle que nous fournissent les chutes d’eau ou la force du vent…
S’il est possible de retransformer en énergie mécanique vraiment utilisable toute l’énergie cinétique de mouvements semblables aux mouvements moléculaires, comment se fait-il que la chaleur, qui semble bien consister en de tels mouvements, ne soit pas intégralement transformable en énergie mécanique ? (…) Le véritable élément objectif de distinction entre une énergie de mouvements d’agitation moléculaire, et une énergie directement utilisable, ne serait-il pas que, dans le mouvement moléculaire, il y a des vitesses dirigées en tous sens, sans ordre, il y a mouvements non coordonnés et que la transformation en mouvements pouvant donner de l’énergie supérieure consisterait à introduire entre ces mouvements une coordination ? Ainsi l’ « ordre » dans l’univers matériel serait la marque de l’utilité, et la mesure de la valeur ; et cet ordre, loin d’être spontané, tendrait constamment à se détruire. Le « désordre », vers lequel marche une collection de molécules, n’est nullement, d’ailleurs, le « chaos » initial, riche de différences et d’inégalités génératrices d’énergies utiles : c’est, au contraire, l’égalité et l’homogénéité moyennes dans le défaut absolu de coordination…
Températures et qualité d’énergie
Une riche source thermale capable de fournir à l’heure 3000 litres à la température de 45 degrés représente une abondante source de chaleur. A supposer que la température de l’extérieur ait une valeur moyenne de 15 degrés, cela fait 30 grandes calories au litre, ou 90.000 grandes calories à l’heure, gratuitement apportées de l’intérieur de la terre. Avec toutes ces calories, il n’y a pourtant pas de quoi faire un œuf à la coque.
Il suffit bien, pour cuire l’œuf, de le maintenir trois minutes dans l’eau bouillante : mais il faut de l’eau bouillante. Et d’innombrables calories prises à une source à 45 degrés ne sauraient suppléer quelques calories en très petit nombre prises à 100 degrés.
Si nous supposions une source thermale à 100 degrés, nous pourrions, à volonté, transformer les calories qu’elle nous apporte à 100 degrés, en calories à 45 degrés, en mêlant l’eau chaude à de l’eau froide. Mais l’inverse ne sera pas réalisable, tout au moins directement. Avec autant de calories que l’on veut, prises à 45 degrés, on n’en fait pas une, prise à 100 degrés.
Les énergies calorifiques que contient une calorie à 100 degrés et une calorie à 45 degrés ne sont donc pas équivalentes « en qualité ».
Celle qui est fournie à la température la plus haute est de meilleure qualité : toutes deux sont de qualité inférieure à de l’énergie mécanique ou électrique.
Dans la production de la chaleur à partir de l’énergie mécanique ou électrique, on n’est limité par aucune température. Si l’on fait passer un courant électrique dans un fil résistant plongé dans un milieu porté déjà à température élevée, le courant électrique aura toujours pour résultat d’élever encore la température en passant.
Seuls, les moyens matériels limitent pratiquement la température atteinte. Il faut des métaux ou des charbons réfractaires pour conduire le courant : mais on atteint, dans l’arc voltaïque, la température de volatilisation du charbon, 3500 degrés.
L’énergie mécanique, transformée par frottement, peut également fournir de la chaleur à une température aussi élevée que l’on veut et, de même, toutes les formes que nous avons décrites comme supérieures. Mais tandis qu’il n’y avait qu’une qualité supérieure d’énergie, il y a autant de degrés dans la qualité inférieure qu’il y a de températures…
Un mémoire récent de J.J. Thomson (Phil Mag d’août 1907) où l’illustre physicien anglais rattache la radiation à l’émission d’énergie électromagnétique par des électrons vibrants, aboutit à la conclusion paradoxale qu’un centimètre cube d’argent pur à la température de 300 degrés absolus, ou 27 degrés centigrades, rayonne par seconde, par l’ensemble de toutes ses molécules, une énergie équivalent à une puissance de 1800 chevaux ? (…)
Ainsi, l’ensemble des molécules solides d’un centimètre cube de charbon, supposé à 27 degrés centigrade, et plongé dans un milieu à la même température, rayonnent soit vers l’extérieur, soit les uns vers les autres, une puissance totale de 7000 chevaux.
Mais il ne faudrait pas croire qu’on puisse extraire toute cette puissance de ce petit cube de charbon ni surtout l’en extraire longtemps.
Pour enlever à ce morceau de charbon l’intégralité de l’énergie susceptible d’être rayonnée, il suffirait d’éparpiller les molécules, de façon que chacune d’elles fût écartée de toutes les molécules voisines – et de les introduire toutes dans un bain au zéro absolu.
Ces deux opérations ne seraient pas très faciles, mais elles se conçoivent bien : alors on extrairait de ces molécules toute l’énergie de radiation de corps noir, mais l’extraction totale ne durerait pas longtemps, et au bout d’une très petite fraction de seconde, le réservoir serait vide.
Si ce taux énorme de rayonnement d’énergie se maintient dans les conditions normales, c’est qu’on remplit le tonneau à mesure qu’on le vide…
La seconde modification qu’apporte l’élévation de température à l’émission d’un corps noir est une modification qualitative. Les rayons émis transmettent un mouvement vibratoire de fréquence d’autant plus haute que la température est plus élevée.
En réalité, le corps noir chauffé n’émet jamais un mouvement vibratoire unique : il ne donne pas une radiation monochromatique, correspondante à une note de hauteur déterminée. Il émet toujours en bloc une masse de vibrations formant un spectre continu ; mais la radiation en laquelle ce spectre se montre le plus riche, a une fréquence qui augmente simplement en proportion de la température absolue. En cela consiste la loi de Wien…
D’une façon générale, les phénomènes naturels comportent toujours dégradation d’énergie. Quand nous mettons la main sur quelque phénomène restaurateur d’énergie utile, nous pouvons nous tenir pour avertis par l’expérience du passé, qu’il y a quelque part dans ce phénomène une dégradation compensatrice…
Les chaleurs de fusion et de vaporisation
Quand la glace fond, elle emprunte de la chaleur au milieu extérieur. Un gramme de glace a besoin, pour fondre, de prendre 80 calories. Il refroidit les corps qui l’entourent autant que le feraient 80 grammes d’eau à zéro degré qu’il faudrait chauffer de un degré.
Cette chaleur de fusion de la glace, qui est énorme, est la raison de l’emploi de la glace comme réfrigérant. Dans la solidification de l’eau, elle se dégage, au contraire, et ralentit le refroidissement, qu’elle arrête pendant tout le temps que dure le changement d’état.
On a donné le nom de « chaleurs latentes » à ces quantités de chaleur dégagées ou absorbées dans les phénomènes de fusion ou de volatilisation.
La chaleur qui est employée et réellement dépensée pour la fusion n’apparaît pas, en effet, sous la forme sensible de chaleur thermométrique ; elle est, en quelque sorte, dissimulée. Elle correspond à un changement du mode d’agrégation des molécules qui, de l’état solide, passent à une nouveau mode d’association qui caractérise l’état liquide. Elle correspond, si l’on veut, à une variation de l’énergie intérieure du corps, variation qu’elle sert précisément à mesurer.
Ce changement d’énergie, qui se manifeste par un changement de l’aspect extérieur et des propriétés du corps, est précisément une des formes les plus intéressantes de l’énergie de qualité inférieure. Il représente de l’énergie de même qualité que de la chaleur elle-même prise à la température à laquelle s’opère le changement d’état.
Il est aussi facile, en élevant ou en abaissant un peu la température du milieu, de provoquer le phénomène qui absorbe de la chaleur ou de provoquer celui qui en dégage…
Rien ne vient contredire la loi générale de la dégradation de l’énergie : le mieux que l’on puisse attendre est de trouver des phénomènes dans lesquels la dégradation est réduite au minimum, et presque à zéro : ce sont les phénomènes réversibles.
Et, d’un autre côté, nous trouvons, dans les phénomènes irréversibles eux-mêmes, tels ceux dont le frottement est le type le plus simple, des moyens pratiques d’ajourner la dégradation inéluctable et de reculer une échéance à laquelle il n’est pas possible d’échapper…
Les transformations d’énergie s’effectuent toujours dans le sens où la qualité de l’énergie se détériore, ou, tout au plus, par échange entre formes d’énergie de même qualité. Précisément cet échange entre formes d’égale qualité constitue l’essence des phénomènes réversibles.
Entre énergie mécanique et énergie électrique, l’échange peut se faire indifféremment dans les deux sens. Entre énergie calorifique et énergie de changement d’état, l’échange peut encore se faire dans les deux sens.
C’est entre énergies de qualités différentes que l’échange ne peut se faire que dans le sens de la dégradation.
Le phénomène irréversible entraîne toujours une dégradation d’énergie. Ainsi, le frottement mécanique, les frottements électrique et magnétique transforment en chaleur des formes supérieures d’énergie. »
Sur la question des chaleurs spécifiques des diverses molécules, inexplicable en Physique classique, lisons Richard Feynman dans son Cours de Physique (Mécanique 2) :
« Lorsque nous comprimons un gaz, nous savons que l’énergie des molécules augmente et nous sommes habitués à dire que le gaz devient de plus en plus chaud ; nous voudrions comprendre ce que ceci a à voir avec la température.
Si nous essayons de faire l’expérience non pas adiabatiquement, sans échange de chaleur, mais à ce que nous appelons une « température constante », que faisons-nous ? Nous savons que si nous prenons deux boîtes de gaz et que nous les mettons l’une à côté de l’autre suffisamment longtemps, même si au départ elles étaient à ce que nous appelons des températures différentes, elles atteindront à la fin la même température.
Qu’est-ce que cela signifie ?
Cela signifie qu’elles atteignent un état qu’elles atteindraient si nous les laissions seules suffisamment longtemps ! Ce que nous signifions par température égale est exactement ceci – l’état final obtenu lorsque les objets se trouvent proches les uns des autres en interaction entre eux suffisamment longtemps.
Considérons maintenant ce qui se passe si nous avons deux gaz, dans des récipients séparés par un piston mobile… manifestement, le bombardement moléculaire du côté gauche doit être tel qu’il déplace le piston vers la droite et comprime l’autre gaz jusqu’à ce sa pression soit suffisante, le piston va alors revenir puis se déplacer de-ci, de-là, et, graduellement, atteindre le repos en un endroit où les pressions seront égales des deux côtés…
Lorsque nous avons deux sortes d’atomes dans un gaz, on peut montrer que l’énergie cinétique moyenne d’une sorte d’atomes est la même que la moyenne de l’énergie cinétique de l’autre sorte, lorsqu’ils sont tous les deux dans le même gaz, dans la même boîte en équilibre…
L’énergie cinétique moyenne moléculaire ne dépend que de la « température ». Ne dépendant que de la « température » et non du gaz, nous pouvons l’utiliser comme définition de la température. L’énergie cinétique moyenne d’une molécule est donc une certaines fonction de la température… Nous utilisons un facteur de conversion constant entre l’énergie d’une molécule et un degré de température absolue appelé un degré Kelvin. la constante de proportionnalité est k égale 1,38 fois dix puissance moins 23 joule par degré Kelvin, ce qui signifie 1,38 joule pour cent mille milliard de milliard de degrés Kelvin (la température Kelvin = température centigrade plus 273,16).
Si T est une température absolue, notre définition dit que l’énergie cinétique moléculaire moyenne est 3/2 de k fois T. En effet, elle est de ½ de k fois T dans une seule direction indépendante de l’espace, mais il y a trois directions…
Nous sommes déjà en possession d’un des théorèmes de la mécanique statistique, à savoir que la valeur moyenne de l’énergie cinétique pour tout mouvement à la température absolue T est la moitié de la constante k fois T pour chaque mouvement indépendant, c’est-à-dire pour chaque degré de liberté…
Notre objectif maintenant est d’en apprendre davantage sur la position des atomes, de découvrir combien d’entre eux se trouvent en différents endroits à l’équilibre thermique, et également de pénétrer un peu plus en détail dans la connaissance de la distribution des vitesses. Bien que nous possédions la moyenne quadratique des vitesses, nous ne savons pas comment répondre à une question telle que : combien d’entre elles vont trois fois plus vite que la moyenne quadratique de la vitesse, ou combien d’entre elles vont à un quart de la moyenne quadratique de la vitesse ? Ou bien, ont-elles toutes exactement la même vitesse ?
Voilà donc les deux questions auxquelles nous allons essayer de répondre. Comment les molécules sont-elles distribuées dans l’espace, lorsqu’il y a des forces qui agissent sur elles et comment sont-elles distribuées en vitesse ?
Il se trouve que ces deux questions sont complètement indépendantes et que la distribution des vitesses est toujours la même. Nous avons déjà eu un aperçu de ce dernier effet lorsque nous avons trouvé que l’énergie cinétique moyenne est la même, la moitié de la constante k fois T par degré de liberté, quelles que soient les forces qui agissent sur les molécules. La distribution des vitesses des molécules est indépendante des forces, parce que la fréquence des collisions ne dépend pas des forces…
Nous trouvons finalement que le nombre de molécules qui traversent une certaine surface avec un composante z de vitesse plus grande que u vaut e à la puissance moins mu² divisé par k fois T ou encore e puissance moins énergie cinétique divisé par k fois T…
En fait, à l’intérieur d’un gaz on préférera savoir combien de molécules se déplacent avec une composante z de la vitesse comprise entre deux valeurs données… En effet, la molécule étant quantique, il n’est pas possible de dire qu’elle est animée exactement d’une certaine vitesse…
La vitesse et la quantité de mouvement étant proportionnelles, nous trouvons que la distribution de quantité de mouvement est également proportionnelle à e puissance moins E fois C divisé par k fois T, où C égale racine de m divisé par deux pi fois kT. et E étant l’énergie cinétique….
Nous allons maintenant envisager certaines manières de vérifier la théorie, et de voir quel est le succès de la théorie classique des gaz.
Nous avons vu précédemment que si U est l’énergie interne de N molécules, on a pour quelques gaz :
pression p fois Volume V égale N fois kT égale U fois (gamma moins 1).
Si c’est un gaz monoatomique, nous savons que c’est aussi égale à 2/3 de l’énergie cinétique du mouvement du centre de masse des atomes. L’énergie cinétique est alors égale à l’énergie interne, et donc gamma moins 1 égale 2/3.
Mais supposons par exemple que ce soit une molécule plus compliquée, qui peut tourner sur elle-même et vibrer, et supposons (ce qui est correct en mécanique classique) que les énergies des mouvements internes soient également proportionnelles à kT. Alors, à une température donnée, en plus de l’énergie cinétique kT, elle dispose d’une énergie interne de vibration ou de rotation.
Ainsi, l’énergie totale U comprend non seulement l’énergie cinétique interne, mais également l’énergie rotationnelle et nous obtenons une valeur différente de gamma.
La meilleure manière, techniquement parlant, de mesurer gamma revient à mesurer la chaleur spécifique qui est le changement d’énergie avec la température…
Par la mesure, nous trouvons les valeurs de gamma suivantes :
Pour le gaz He à T = -180°C gamma égale 1,660
Pour le gaz Kr à T = 19°C gamma égale 1,68
Pour le gaz Ar à T = 15°C gamma égale 1,668
Pour le gaz H² à T = 100°C gamma égale 1,404
Pour le gaz O² à T = 100°C gamma égale 1,399
Pour le gaz HI à T = 100°C gamma égale 1,40
Pour le gaz Br² à T = 300°C gamma égale 1,32
Pour le gaz I² à T = 185°C gamma égale 1,30
Pour le gaz NH3 à T = 15°C gamma égale 1,310
Pour le gaz C2H6 à T = 15°C gamma égale 1,22
Le gaz diatomique hydrogène, avec 1,404, n’est pas en accord avec la théorie qui donnerait 1,286. En effet, on trouve pour H² que le total de l’énergie U vaut 7/2 de kT, ou encore que kT vaut 2/7 par atome. Cela signifie que gamma moins 1 vaut 2/7 et donc que gamma vaut 9/7 soit 1,286…
Considérons une molécule encore plus compliquée avec un grand nombre de morceaux, par exemple C2H6, qui est l’éthane. Elle possède huit atomes différents et ils sont tous en train de vibrer et de tourner dans des combinaisons diverses, de telle sorte que la quantité totale d’énergie interne doit être égale à un grand nombre de fois kT, au moins 12 kT pour l’énergie cinétique seulement et gamma moins 1 doit être proche de zéro ou gamma presque égal à 1.
En fait, il devrait être plus faible et il est… de 1,22 ce qui est plus grand ! C’est tout simplement incompréhensible !
Ainsi, pour tout dire, nous devons reconnaître qu’il y a quelques difficultés.
Nous pouvons essayer certaines lois de forces autres que celles d’un ressort, mais il apparaît que tout cela ne pourra qu’augmenter gamma. Si nous augmentons le nombre de formes d’énergie, gamma se rapproche de l’unité, contredisant les faits.
Toutes les idées classiques auxquelles on peut penser ne peuvent que faire empirer la situation. Le fait est qu’il y a des électrons dans chaque atome, et nous savons à partir de leurs spectres qu’ils ont des mouvements internes ; chaque électron doit avoir au moins un demi k fois T d’énergie cinétique, et quelque chose pour l’énergie potentielle, et lorsque nous ajoutons cela, gamma devient encore plus petit. C’est ridicule. C’est faux.
La première grande publication sur la théorie des gaz fut écrite par Maxwell en 1859. Sur la base des idées que nous venons de discuter, il était capable d’expliquer avec précision un grand nombre de relations connues comme la loi de Boyle-Mariotte, la théorie de la diffusion, la viscosité des gaz…
Il rassembla tous ces grands succès dans un résumé final, et à la fin, parlant du théorème en un demi de kT, il dit :
« Finalement, en établissant une relation nécessaire entre les mouvements de translation et de rotation de toutes les particules non sphériques, nous avons montré qu’un système de telles particules ne peut pas satisfaire les relations connues entre les deux chaleurs spécifiques. »
Il fait référence à gamma (qui est relié aux deux manières de mesurer les chaleurs spécifiques), et il dit que nous savons que nous ne pouvons pas obtenir la bonne réponse.
Dix ans plus tard, dans une conférence, il disait :
« Je viens maintenant de vous présenter ce que je considère comme étant la difficulté la plus grande, rencontrée jusqu’à présent par la théorie moléculaire. »
Ces mots représentent la première découverte que les lois de la physique classique étaient fausses. Ce fut la première indication qu’il y avait quelque chose de fondamentalement impossible, car un théorème rigoureusement démontré n’était pas en accord avec l’expérience.
Aux environs de 1890, Jeans parla à nouveau de ce problème. On entend souvent dire que les physiciens dans la dernière partie du dix-neuvième siècle estimaient connaître toutes les lois de la physique, et que la seule chose importante qui leur restait à faire était de calculer quelques décimales de plus. Quelqu’un a pu dire cela une fois, et d’autres l’ont copié. Mais une lecture attentive de la littérature scientifique de cette époque montre que quelque chose les préoccupait tous. Jeans disait de ce problème que c’est un phénomène très mystérieux, et qu’il semble que, lorsque la température diminue, certains types de mouvements soient « gelés ».
Si nous pouvons supposer que le mouvement vibrationnel, par exemple, n’existe pas à basse température et existe à haute température, alors nous pouvons imaginer qu’un gaz puisse exister à une température suffisamment basse pour que le mouvement vibrationnel ne se produise plus, de telle sorte que gamma égale 1,40 ou à une température plus élevée à laquelle le mouvement commence d’apparaître, de telle sorte que gamma diminue.
La même chose peut être avancée pour la rotation. Si nous pouvons éliminer la rotation, si par exemple elle est « gelée » à une température suffisamment basse, nous pouvons comprendre le fait que le gamma de l’hydrogène tende vers 1,66 lorsque nous diminuons la température.
Comment pouvons-nous comprendre un tel phénomène ?
Il va de soi que nous ne pouvons pas comprendre par la mécanique classique que ces mouvements soient « gelés ». Cela ne fut compris que lorsque la mécanique quantique fut découverte…
Le résultat simple en mécanique classique… disant que le nombre de molécules qui traversent une certaine surface avec un composante z de vitesse plus grande que u vaut e à la puissance moins mu² divisé par k fois T ou encore e puissance moins énergie cinétique divisé par k fois T… devient le théorème de la mécanique quantique suivant et très important :
Si les énergies de l’ensemble des états moléculaires sont appelées par exemple E0, E1, E2,….,Ei…, la probabilité de trouver à l’équilibre une molécule dans un état particulier ayant l’énergie Ei est proportionnelle à e puissance moins Ei divisé par kT…
Pour un oscillateur harmonique, les niveaux d’énergie sont également espacés :
Si E0 est considéré comme proche de zéro, ou comme convention du zéro, alors
E1 = h fois oméga divisé par deux pi
E2 = deux h fois oméga divisé par deux pi
E3 = trois h fois oméga divisé par deux pi
etc…
Oméga est la pulsation de l’oscillateur harmonique.
Voyons maintenant ce qui se passe. Nous supposons que nous étudions les vibrations d’une molécule diatomique (deux atomes), que nous décrivons d’une manière approchée par un oscillateur harmonique. Demandons-nous quelle est la chance relative de trouver une molécule dans l’état E1 plutôt que E0, diminue comme e puissance moins k fois oméga divisé par deux pi fois kT.
La réponse est que la chance de la trouver dans l’état E1, par rapport à celle de la trouver dans l’état E0, diminue comme e puissance moins h fois oméga divisé par deux pi fois kT.
Supposons maintenant que kT soit beaucoup plus petit que h fois oméga divisé par deux pi et que nous soyons à basse température. La probabilité de se trouver dans l’état E1 est extrêmement petite. Pratiquement tous les atomes sont dans l’état E0.
Si nous changeons la température, mais que celle-ci reste toujours très petite, la chance de se trouver dans l’état E1 reste infinitésimale, l’énergie de l’oscillateur reste pratiquement nulle ; elle ne change pas avec la température, aussi longtemps que la température est très inférieure à h fois oméga divisé par deux pi. Tous les oscillateurs sont alors dans l’état fondamental et leur mouvement est effectivement « gelé » ; il n’y a pas de contribution de leur part à la chaleur spécifique. »
Petit historique des idées sur la chaleur :
Petit historique des idées sur la chaleur :
Francis Bacon dans « Le Nouvel 0rganum » en 1620
L’Encyclopédie de Diderot et d’Alembert en 1751
LIRE AUSSI :
Qu’est-ce que le mouvement brownien
« Rien ne se perd, rien ne se crée, tout se transforme » ?
D’où vient la chaleur du noyau terrestre
D’où vient la chaleur issue des étoiles
D’où vient l’énergie stockée dans la matière
Qu’est-ce que l’énergie du vide quantique
Comment nous concevons l’atome
Le frottement, une des origines de la chaleur
Ecouter les conférences sur la chaleur
« L’évolution des idées en Physique » de Einstein/Infeld :
« Est-il possible d’expliquer les phénomènes de la chaleur par des mouvements de particules agissant les unes sur les autres au moyen de forces simples ?
Un vase fermé contient une certaine masse d’un gaz, d’air par exemple, à une certaine température. En chauffant, nous élevons la température et augmentons l’énergie. Mais de quelle façon cette chaleur est-elle liée au mouvement ?
La possibilité d’une telle connexion est suggérée aussi bien par notre point de vue philosophique, accepté provisoirement, que par la façon dont la chaleur est produite par le mouvement.
La chaleur doit être une énergie mécanique, si tout problème est un problème mécanique. L’objet de la « théorie cinétique » est de présenter le concept de la matière justement de cette manière.
Un gaz, selon cette théorie, est un amas d’un nombre énorme de particules ou « molécules », qui se meuvent dans toutes les directions, se heurtent les unes aux autres et changent de direction après chaque collision.
Il doit exister une vitesse moyenne de ces molécules, exactement comme dans une grande communauté humaine il existe un âge moyen ou une richesse moyenne. Il y aura, par conséquent, une énergie cinétique moyenne par particule.
Plus de chaleur dans le vase signifie une énergie cinétique moyenne plus grande. La chaleur, conformément à cette image, n’est pas une forme spéciale d’énergie, différente de l’énergie mécanique ; elle est exactement l’énergie cinétique du mouvement moléculaire.
A une température définie correspond, par particule, une énergie cinétique moyenne définie. Ceci n’est pas une supposition arbitraire. Nous sommes obligés de regarder l’énergie cinétique d’une molécule comme la mesure de la température d’un gaz, si nous voulons former une consistante image mécanique de la matière.
Cette théorie est plus qu’un jeu de l’imagination. On peut montrer que la théorie cinétique des gaz n’est pas seulement en accord avec l’expérience, mais qu’elle conduit réellement à une intelligence plus profonde des faits.
Ceci peut être illustré par quelques exemples.
Nous avons un vase fermé par un piston qui peut se mouvoir librement. Le vase contient une certaine quantité de gaz qui doit garder une température constante. Si, au début, le piston est au repos en gardant une certaine position, il se mouvra vers le haut, si l’on diminue son poids, et vers le bas, si l’on augmente ce dernier.
Pour pousser le piston en bas, il faut employer une force qui agit contre la pression intérieure du gaz.
Quel est, d’après la théorie cinétique, le mécanisme de cette pression intérieure ?
Un nombre énorme de particules constituant le gaz se meuvent dans toutes les directions. Elles bombardent les parois et le piston et rebondissent comme des balles qu’on lance contre un mur.
Le bombardement continuel d’un grand nombre de particules tient le piston à une certaine hauteur, en s’opposant à la force de la pesanteur, qui agit vers le bas sur le piston et les poids.
Dans une direction agit constamment la force de la gravitation, dans la direction opposée un très grand nombre de chocs irréguliers venant des molécules. Pour qu’il y ait équilibre, il faut que l’effet net sur le piston de toutes ces petites forces irrégulières soit égal à celui de la force de la gravitation.
Supposons que le piston soit poussé vers le bas de façon à comprimer le gaz d’une fraction de son volume, disons de la moitié, sa température restant invariable.
Que doit-il arriver selon la théorie cinétique ?
La force due au bombardement sera-t-elle plus grande qu’avant ou moins grande ? Les particules sont maintenant plus serrées. Bien que l’énergie cinétique moyenne soit toujours la même, les chocs des particules contre le piston seront maintenant plus fréquents et la force totale sera ainsi plus grande. De cette image que présente la théorie cinétique il résulte clairement que, pour maintenir le piston dans cette position plus basse, il faut employer un poids plus grand. Ce fait expérimental simple est bien connu, mais sa prévision découle logiquement de la conception cinétique de la matière.
Considérons un autre dispositif expérimental. Prenons deux vases contenant des volumes égaux de gaz différents, par exemple d’hydrogène et d’azote, tous les deux étant à la même température. Supposons que les deux vases soient fermés par des pistons identiques et chargés de poids égaux.
Ceci signifie, en bref, que les gaz ont le même volume, sont à la même température. Puisque la température est la même, l’énergie cinétique moyenne, par particule, est, d’après la théorie, la même. Et puisque les pressions sont égales, les deux pistons sont bombardés par la même force totale. En moyenne, chaque particule porte la même énergie et les deux vases ont le même volume. Donc le nombre des molécules doit être le même dans chaque vase, bien que les gaz soient chimiquement différents.
Ce résultat très important permet de comprendre beaucoup de phénomènes chimiques. Il signifie que le nombre des molécules dans un volume donné, à une certaine température et à une certaine pression, n’est pas la caractéristique d’un gaz particulier, mais de tous les gaz. Il est au plus haut degré curieux de constater que la théorie cinétique non seulement prédit l’existence d’un tel nombre universel, mais nous rend aussi capables de le déterminer. Nous reviendrons bientôt sur ce point.
La théorie cinétique de la matière explique, quantitativement aussi bien que qualitativement, les lois des gaz déterminées par l’expérience.
En outre, la théorie n’est pas limitée aux gaz, bien que ce soit dans ce domaine qu’elle a obtenu ses plus grands succès.
Un gaz peut être liquéfié, si l’on fait baisser sa température. La chute de température que subit une matière signifie que ses particules subissent une décroissance de l’énergie cinétique moyenne. Il est ainsi clair que l’énergie cinétique moyenne d’une particule liquide est plus petite que celle d’une particule gazeuse correspondante.
Le mouvement de particules dans un liquide fut rendu manifeste, pour la première fois, par le « mouvement brownien », phénomène remarquable, qui serait resté mystérieux et incompréhensible sans la théorie cinétique de la matière.
Il a été observé par le botaniste Brown et expliqué quatre-vingt ans plus tard, au début de ce siècle… Ce que Brown observait, c’était l’agitation incessante de granules en suspension dans l’eau et visibles au microscope…
Comment faut-il expliquer ce mouvement ?
Il paraît contradictoire à toute l’expérience antérieure. L’observation de la position d’une de ces particules en suspension pendant trente secondes par exemple révèle la forme fantastique de son chemin.
La chose bouleversante, c’est le caractère de son mouvement apparemment éternel…
Cette difficulté fut éclaircie d’une manière éclatante par la théorie cinétique de la matière. »

